U.O.S. Ricerca Clinica e Valutazione Farmaci e Unità per la Ricerca Clinica (U.R.C.)
Responsabile: Dr.ssa Roberta Joppi 045 8076056
Segreteria Tecnico scientifica
- Referente: Dr.ssa Antonella Scandola
- Tel. 045 8076057 - 045 8075833
- Fax: 0458076099
- E-mail: nrc@aulss9.veneto.it
Sede
- Via Salvo D’Acquisto n. 7 – 37122 Verona
Orario contatti con il pubblico
- da Lunedì a Venerdì: ore 8.30 - 14.30
L’UOS Ricerca Clinica e Valutazione Farmaci coordina l'Unità per la Ricerca Clinica (URC) aziendale e la gestione tecnico scientifica della relativa Segreteria. L’Unità per la Ricerca Clinica Aziendale (URC), ai sensi della DGR 330/2023 (istituito con delibera Aziendale n. 580 del 14/06/2023), è l’organismo tecnico-scientifico che fa da collegamento tra i ricercatori, le organizzazioni di ricerca a contratto e i promotori degli studi clinici, il Comitato Etico Territoriale Area Sud Ovest Veneto (CET-ASOV) e tutti i CET nazionali.
Attività svolta dal U.R.C.
Attività di supporto ai ricercatori e di sostegno alla ricerca clinica:
Nell’ambito sia ospedaliero che territoriale dell’Azienda ULSS l’URC assicura una gestione organica degli studi e una efficace valutazione della fattibilità locale degli studi, superando le eventuali criticità che dovessero emergere in sede di istruttoria e prima che gli studi siano presentati al CET.
Tale attività di supporto è garantita anche per tutte le strutture private accreditate ubicate nel Territorio dell’ULSS9 (Ospedale P. Pederzoli, Casa di Cura Villa Garda, Casa di Cura Villa Santa Chiara, Clinica San Francesco,…).
Regolamento U.R.C. v. del 27-2-2025 (approvato con delibera Aziendale n. 535 del 06/5/2025) - scarica il regolamento
Attività di formazione sulla Ricerca Clinica: Corso di formazione sulla ricerca clinica 2019.
Per maggiori informazioni su cosa fare se si intende condurre uno studio clinico nel territorio dell’AULSS9 Scaligera vedere la specifica sezione ”TIPOLOGIA DI STUDI (per sperimentatori e promotori)”.
Attività locali:
Tavolo provinciale per il Governo del File F: Tavolo-Provinciale-File-F_DGR_n.28_2016
Gruppo di lavoro provinciale sulle Malattie Infiammatorie Croniche Intestinali (MICI):
Delibera n.44/2019: Aggiornamento componenti del Gruppo di lavoro e approvazione PDTA MICI
PDTA Malattie Infiammatorie Croniche Intestinali, gennaio 2019
Convegno MICI 2018-11-10-Verona
Gruppo di lavoro provinciale sulle Artriti Croniche:
Delibera n.44/2019: Aggiornamento componenti del Gruppo di lavoro e approvazione PDTA Artriti Croniche
PDTA Artriti Croniche, gennaio 2019
Convegno 2019-06-08. Verona
Attività nazionali ed internazionali:
Italian Horizon Scanning Project (IHSP): progetto finalizzato all’identificazione di farmaci emergenti prossimi alla commercializzazione, al fine di valutarne in anticipo il grado di innovazione e il potenziale impatto sul Servizio Sanitario Nazionale (SSN) e su quello Regionale (SSR).
- Delibera DG-IHSP Delibera di istituzione del progetto IHSP
- "Italian Horizon Scanning Project: Un sistema di allerta precoce per farmaci emergenti" Eur J Clin Pharmacol (2009)
- “Italian Horizon Scanning Project: Un sistema di allerta precoce per farmaci emergenti" GIHTA, 2013
EuroScan: Nel 2008 IHSP è stato riconosciuto a livello internazionale, entrando a far parte di EuroScan, un network collaborativo internazionale di Centri di Allerta Precoce per l’identificazione e la valutazione critica di tecnologie sanitarie emergenti, cioè non ancora impiegate nella pratica clinica, o nuove, cioè di prima adozione.
A toolkit for the identification and assessment of new and emerging health technologies, traduzione italiana, febbraio 2019.
Per maggiori informazioni: http://www.euroscan.org.
In corso
L’UOS Ricerca Clinica e Valutazione Farmaci promuove, supporta e svolge direttamente attività di ricerca d’interesse per il miglioramento della pratica clinica quale parte integrante dell’assistenza sanitaria.
I progetti di ricerca avviati nell’anno 2019 sono:
- RI-MICI: Un modello di Rete Integrata tra medici specialisti e medici di famiglia a favore dei pazienti con MICI della provincia di Verona
- RESP-LONG-2019: Come va il tuo respiro? Uno studio osservazionale retrospettivo su database amministrativi dell’Azienda Ulss 9 Scaligera
AVVISI RELATIVI AGLI STUDI PER CUI NON E' POSSIBILE RACCOGLIERE IL CONSENSO
| TITOLO DELLO STUDIO | STRUTTURA DI COMPETENZA | AVVISO |
| STUDIO RETROSPETTIVO SULLA SICUREZZA POST-AUTORIZZAZIONE ALL'IMMISSIONE IN COMMERCIO DI FARMACI, C.D. PASS, IN MERITO ALL'UTILIZZO OFF LABEL DI MISOPROSTOLO (DA SOLO O IN COMBINAZIONE CON DICLOFENAC) | U.O.C. OSTETRICIA E GINECOLOGIA – OSPEDALE MAGALINI DI VILLAFRANCA P.I.: DR. MARCO TORAZZINA |
AVVISO |
- la documentazione che il promotore e/o lo sperimentatore è tenuto a predisporre per la valutazione di uno studio clinico da parte del Comitato Etico Territoriale Area Sud-Ovest (CET ASOV) o CET nazionale;
- la modulistica centro-specifica che deve essere completata a cura dello sperimentatore locale e trasmessa da quest’ultimo all’Unità Ricerca Clinica dell’Azienda Ulss 9 Scaligera;
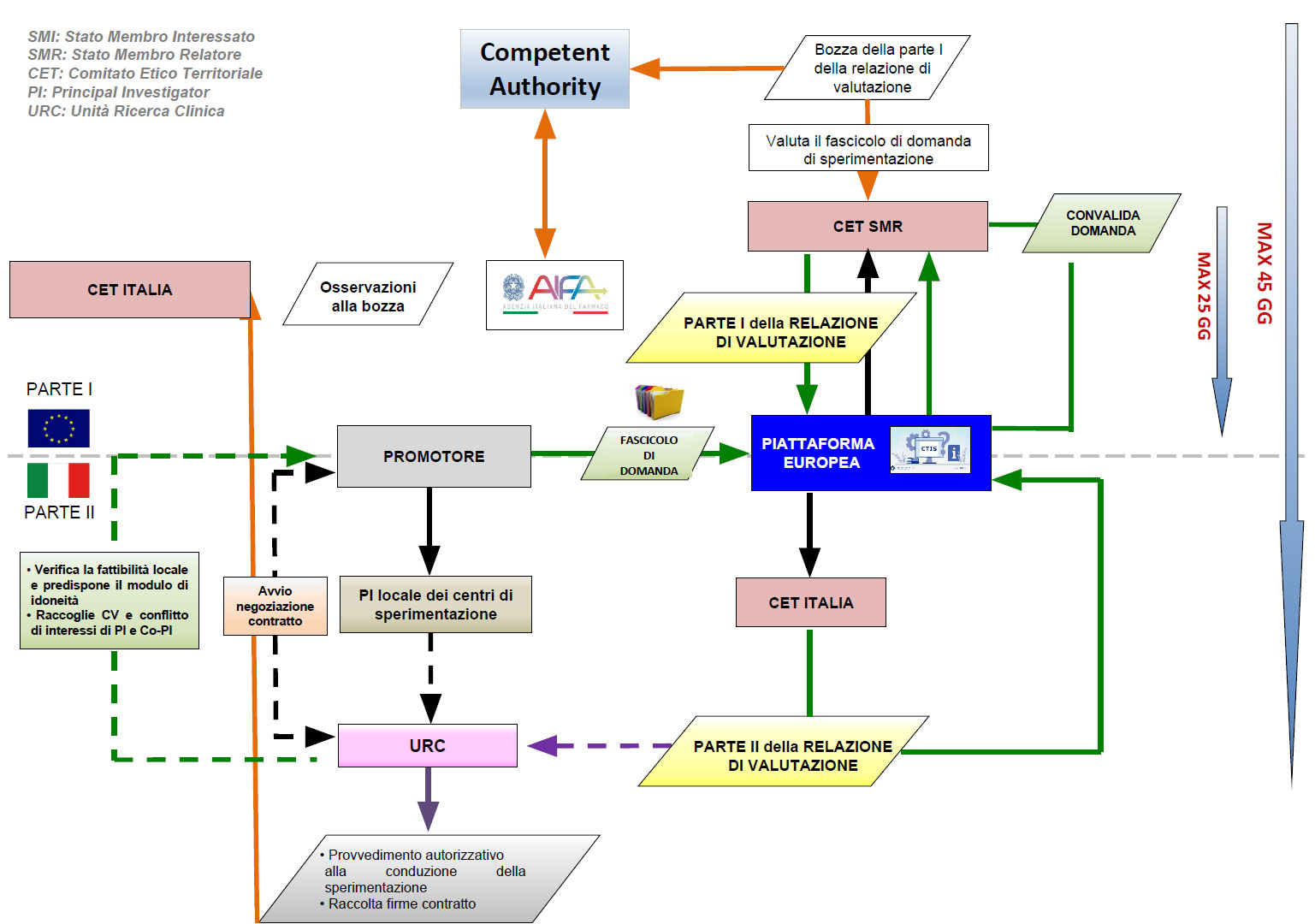
Nel caso di Sperimentazioni Cliniche con Medicinali, queste vengono sottomesse dal Promotore tramite il Clinical Trials Information System (CTIS) secondo quanto previsto dal Regolamento EU 536/2014 e dalle indicazioni presenti sul sito istituzionale di AIFA.
La documentazione da presentare, di competenza del CET, deve essere in linea con quanto previsto nell’Allegato I del Regolamento UE 536/2014 (dalla lettera K alla lettera R).
Per la modulistica da utilizzare bisogna fare riferimento a quanto previsto dal Centro di Coordinamento Nazionale dei Comitati Etici (CCNCE) territoriali per le sperimentazioni cliniche sui medicinali per uso umano e sui dispositivi medici clicca qui. In fase di presentazione dello studio farmacologico sperimentale contattare l’Unità di Ricerca Clinica dell’Ulss 9 per la predisposizione dei seguenti documenti centro-specifici:
- documento di Idoneità Sito Specifica, a firma del:
- Direttore della U.O.C. Assistenza Farmaceutica Territoriale (su delega del Direttore Generale prot.n. 12660 del 03/07/2023 per gli studio condotti in strutture afferenti all’Azienda Ulss 9 Scaligera). Scarica il documento;
- Direttore Ospedale P. Pederzoli Casa di Cura Privata S.p.A., per gli studi condotti presso tale struttura.
- convenzione tra lo Sponsor e l’Azienda Ulss 9 Scaligera.
Per la tipologia di questi studi è previsto il rilascio di un Parere Unico a livello nazionale da parte di uno specifico Comitato Etico Territoriale (CET), che valuterà per tutti i centri partecipanti alla ricerca.
Elenco documenti da presentare ai Comitati Etici della Regione Veneto per il rilascio del Parere Unico valido su tutto il territorio nazionale.
- Modulo 1 Lettera trasmissione studi altro osservazionali
- Modulo 2 Lettera trasmissione studi con DM
- Modulo 3 Modulo di domanda per indagine clinica PMCF
- Modulo 4 Dichiarazione noprofit DEVICE ALTRO
- Modulo 5 Dichiarazione noprofit DM 30nov21 FARMACI
- Modulo 6 Sinossi in italiano
- Modulo 7 Dichiarazione a cura del Promotore sulla natura Osservazionale
- Modulo 8 Informativa e consenso trattamento dati
- Modulo 9 Modulo di Idoneita sito specifico DM
- Modulo 10 Modulo di fattibilità locale
- Modulo 11 Dichiarazione costi aggiuntivi e compensi sperimentatori
- Modulo 12 Dichiarazione PI osservazionale dispositivo medico
- Modulo 13 Dichiarazione PI osservazionale altro
- Modulo 14 Modulo di domanda per il CE uso compassionevole
- Modulo 15 Esempio Protocollo Uso Terapeutico
- Modulo 16 Lettera di trasmissione emendamento sostanziale
- Modulo 17a Dichiarazione interessi Centro coordinamento Aulss9
- Modulo 17b Dichiarazione interessi Centro coordinamento altri centri
- Modulo 18 CV sperimentatore principale Centro coordinamento
- Modulo 19 Informative pazienti (centro coordinamento)
- Modulo 20 Convenzioni (centro coordinamento)
- Modulo 21 Modello raccolta conservazione uso futuro campioni biologici
- Modulo 22 Documento descrizione misure disposizioni privacy DM e IVD
Altre tipologie di studio (sperimentali s/farmaco e dispositivo, osservazionali s/farmaco e dispositivo, osservazionali con farmaco retrospettivi, studi con IVD)
Le domande di valutazione dovranno essere compilate presentando l’appropriata documentazione ed inviate via mail all’Unità Ricerca Clinica, che ne effettuerà una verifica formale della completezza, e provvederà a sottomettere la pratica alla segreteria del Comitato Etico Territoriale Area Sud-Ovest (CET ASOV), per la valutazione dello studio nella prima seduta utile:
Elenco documenti da presentare all’URC:
- Modulo 1 Lettera trasmissione studi altro osservazionali
- Modulo 2 Lettera trasmissione studi con DM
- Modulo 3 Modulo di domanda per indagine clinica PMCF
- Modulo 4 Dichiarazione noprofit DEVICE ALTRO
- Modulo 5 Dichiarazione noprofit DM 30nov21 FARMACI
- Modulo 6 Sinossi in italiano
- Modulo 7 Dichiarazione a cura del Promotore sulla natura Osservazionale
- Modulo 8 Informativa e consenso trattamento dati
- Modulo 9 Modulo di Idoneita sito specifico DM
- Modulo 10 Modulo di fattibilità locale
- Modulo 11 Dichiarazione costi aggiuntivi e compensi sperimentatori
- Modulo 12 Dichiarazione PI osservazionale dispositivo medico
- Modulo 13 Dichiarazione PI osservazionale altro
- Modulo 14 Modulo di domanda per il CE uso compassionevole
- Modulo 15 Esempio Protocollo Uso Terapeutico
- Modulo 16 Lettera di trasmissione emendamento sostanziale
- Modulo 17a Dichiarazione interessi Centro coordinamento Aulss9
- Modulo 17b Dichiarazione interessi Centro coordinamento altri centri
- Modulo 18 CV sperimentatore principale Centro coordinamento
- Modulo 19 Informative pazienti (centro coordinamento)
- Modulo 20 Convenzioni (centro coordinamento)
- Modulo 21 Modello raccolta conservazione uso futuro campioni biologici
- Modulo 22 Documento descrizione misure disposizioni privacy DM e IVD
Il Centro sede della ricerca è una struttura afferente al CET:
Le domande di emendamento sostanziale dovranno essere compilate ed inviate via mail all’Unità di Ricerca Clinica, che provvederà verificare la correttezza e la completezza, e a sottomettere la pratica alla Segreteria del CET entro la deadline prevista dal Calendario Riunioni.
Il Centro sede della ricerca NON è una struttura afferente al CET:
La sottomissione avverrà per mezzo del Promotore.
Il centro sede della ricerca è una struttura afferente al CET:
Le richieste dovranno pervenire tramite mail all’Unità di Ricerca Clinica, che si occuperà di inviarle al CET per presa visione.
Il Centro sede della ricerca NON è una struttura afferente al CET:
La sottomissione avverrà per mezzo del Promotore. Il Centro sede della ricerca NON è una struttura afferente al CET: La sottomissione avverrà per mezzo del Promotore.
ALTRE INFORMAZIONI
- Comunicazioni relative al MONITORAGGIO dello studio (notifica arruolamento primo paziente, stato di avanzamento locale, dichiarazione di avvio studio, relazione di chiusura studio);
- Comunicazione relative a modifiche della fattibilità locale (modifica al budget, modifica alla fattibilità, proroghe comodati d’uso);
I documenti dovranno pervenire tramite mail al’URC, che si occuperà di inviarli al CET per presa visione, previa verifica della documentazione.
Il CET ASOV valuta le richieste di Uso Terapeutico di Medicinale Sottoposto a Sperimentazione Clinica secondo il DM 07/09/2017.
Le domande di valutazione vanno inviate direttamente all'Ufficio di Segreteria Tecnico-Scientifica del CET email: comitatoetico@aovr.veneto.it
QUOTA DI MONITORAGGIO DELL’IMPORTO UNA TANTUM DI EURO 2.000,00, DESTINATA ALL’UNITÀ DI RICERCA CLINICA DELL’AZIENDA ULSS 9 SCALIGERA, PREVIA FIRMA DEL CONTRATTO
Versamento effettuato da Società con sede legale all’estero
Il pagamento dev’essere effettuato mediante bonifico; l’IBAN può essere richiesto tramite mail all’indirizzo nrc@aulss9.veneto.it.
ATTENZIONE!La CAUSALE del bonifico deve contenere le seguenti informazioni:
- se disponibile, numero di riferimento alla fattura;
- se si tratta di uno studio: CODICE PROTOCOLLO (e/o EudraCT) e PI.
Versamento effettuato da Società con sede legale in Italia
Il pagamento dev’essere effettuato obbligatoriamente a mezzo PagoPA.
E’ necessario inviare all’indirizzo nrc@aulss9.veneto.it le informazioni dettagliate relative a:
- CODICE PROTOCOLLO,
- NOME DELLO SPERIMENTATORE PRINCIPALE
- CODICE UNIVOCO
- RIFERIMENTI a cui intestare ed inviare la fattura e relativo avviso PagoPA.
Per gli emendamenti:
- NUMERO e DATA dell’emendamento;
- CODICE UNIVOCO;
- RIFERIMENTI a cui intestare ed inviare la fattura e relativo avviso PagoPA.
Entro 30 giorni dalla sottoscrizione del contratto, sarà emessa la fattura con avviso di PagoPA mediante il quale effettuare il pagamento.
Si informa che le quote ricevute mediante bonifico non potranno più essere considerate valide.

